서론
가와사키병(Kawasaki Disease, KD)은 우리나라 소아에서 발생하는 가장 흔한 전신 혈관염(systemic vasculitis)이다[1]. 정맥주사 면역글로불린(intravenous immunoglobulin, IVIG)을 KD 치료에 적용하면서 관상동맥 이상(coronary artery abnormalities, CAAs)을 포함한 심장 합병증의 빈도가 현저하게 감소하였다[2–4]. IVIG는 상대적으로 안전한 치료 약제이지만, 치료받은 환자의 생체 내 일정 기간 동안 그 농도가 유지되어 추후 시행하는 예방접종에 영향을 줄 수 있다[5,6]. KD 환자를 진료하는 임상의는 입원기간 동안 적절한 치료방법을 제공하고, 퇴원 후 추적기간 동안 심장 합병증 평가와 함께 올바른 예방접종 방법을 보호자에게 안내할 수 있어야 한다.
소아 및 청소년에게 예방접종을 시행할 때, 과거에 환자가 치료받은 약제의 종류, 용량, 투여 방법, 반감기, 화학적 특성 등 약리학적 특징을 고려해야 한다[7,8]. 다른 치료약제들과 마찬가지로, IVIG 치료를 받은 KD 소아에게 올바른 예방접종을 안내하려면 IVIG의 특성과 IVIG 치료 후 예방접종에 대한 이해가 필요하다[9,10]. 본 연구에서 저자들은 국내외 가이드라인과 관련 연구들을 검토하여 IVIG 치료를 받은 KD 소아 예방접종의 기본 원리와 실제 적용방법을 제시하고자 한다.
본론
IVIG의 주요한 작용기전은 항체의 용량과 기저 질환의 병리기전에 따라 결정된다[11,12]. 주요한 4가지 기전에는 (1) 항원 결합 분절(fragment antigen-binding, Fab)의 가변 영역에 의해 매개되는 작용; (2) 결정화 가능 분절(fragment crystallizable, Fc)의 작용; (3) Fc 내의 보체(complement) 결합에 의해 매개되는 작용 및 (4) IVIG 제제 내의 항체 외의 면역조절 물질에 의한 작용이 포함된다[7]. 이러한 IVIG의 작용을 근거로, 미국 식품의약국(Food and Drug Administration, FDA)은 KD를 포함한 다수의 질병 치료에 IVIG의 사용을 승인하였다[13]. 실제 임상에서는 FDA와 같은 기관의 승인 없이(off-label) 다양한 질병 치료에 IVIG를 활용하고 있다(Table 1)[6,14–16].
| Neurology |
|---|
| Guillain Barre syndrome, myasthenia gravis, Lennox gastaut seizure, Landau kleffner seizure, opsoclonus myoclonus ataxia, PANDAS |
| Hematology |
|---|
| Pure red cell aplasia, pure white cell aplasia, immune neutropenia, hemolytic anemia |
| Neonatology |
|---|
| Hemolytic disease of newborn due to Rh and ABO incompatibility, neonatal alloimmune thrombocytopenic purpura, bacterial sepsis in preterm |
IVIG: intravenous immunoglobulin; FDA: Food and Drug Administration; CVID: common variable immunodeficiency; XLA: X-Linked agammaglobulinemia; WAS: Wiskott-Aldrich syndrome; HIV: human immunodeficiency virus; PANDAS: Pediatric autoimmune neuropsychiatric disorders associated with streptococcal infection.
IVIG의 제조 공정이나 제조 회사에 따라 핵심적인 면역학적 효과가 정성적, 정량적으로 차이를 보일 수 있기 때문에, 세계보건기구(World Health Organization, WHO)는 IVIG에 대한 5가지 제품기준을 제시하였다[8]: (1) IVIG의 각 로트(lot)는 최소 1,000명 이상의 공여자로부터 수집된 혈장에서 추출되어야 한다. (2) IVIG에는 면역글로불린 G (immunoglobulin G, IgG)가 최소 90% 이상 포함되어야 한다. (3) IgG 분자는 보체 고정(fixation)과 같은 생물학적 활성을 보유해야 한다. (4) IVIG에는 프리칼리크레인(prekallikrein) 활성화 물질, 혈장 프로테아제(proteases) 및 방부제 같은 오염 물질이 포함되지 않아야 한다. (5) IVIG에는 감염원이 포함되지 않아야 한다. 따라서 모든 혈액 제제 공여자는 B형과 C형 간염, 매독, 후천면역결핍증(acquired immune deficiency syndrome, AIDS)에 대한 선별검사를 받아야 한다.
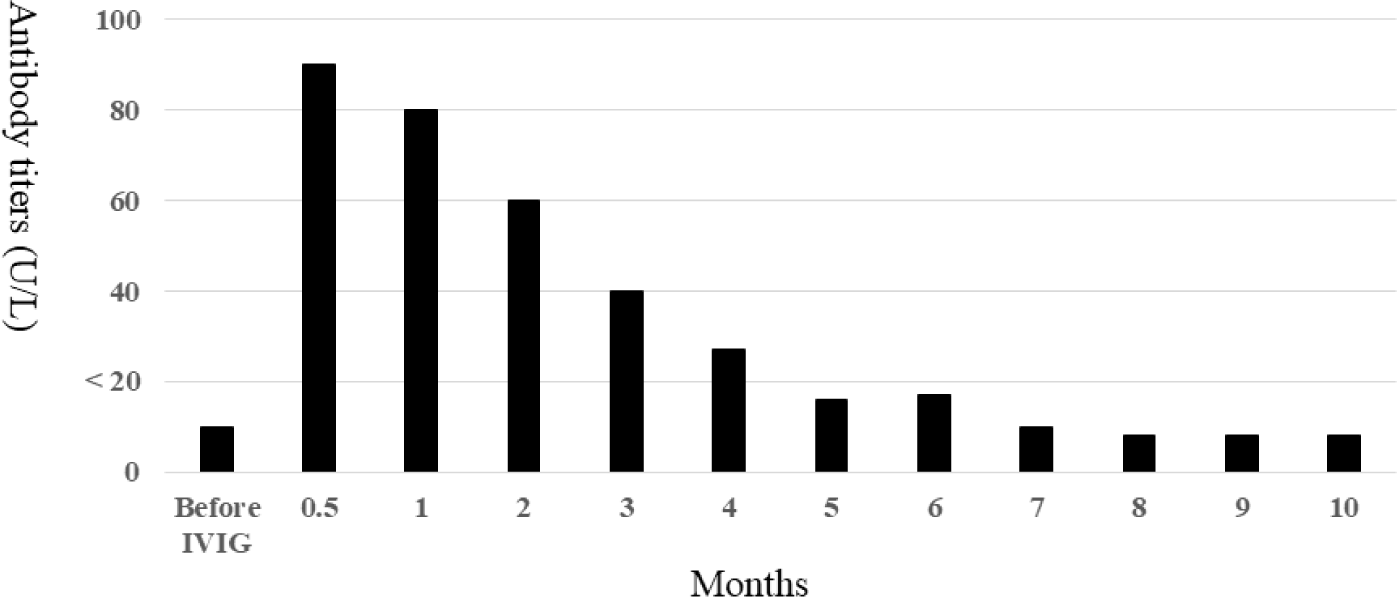
모체에서 태아에 생리적을 전달된 항체는 그 종류와 용량에 따라서 생체 내 유지기간이 다를 수 있으며, 최대 12–18개월까지 검출될 수 있다[17,18]. 하지만, 인위적인 수동 면역(passive immunization) 과정에서 투여된 항체의 검출기간은 상대적으로 짧다[15]. Table 2에는 면역글로불린이나 수혈 치료 후 홍역이나 수두를 포함하는 백신의 추천되는 접종간격을 나타냈다[9,10]. 치료에 적용된 면역글로불린의 종류와 용량에 따라 백신의 접종가능한 시기를 추천하고 있다. 일반적으로 ‘면역 보충’을 위한 저용량 면역글로불린(400 mg/kg/dose)은 매월 투여하며, ‘면역 조절’을 위한 고용량 면역글로불린(2,000 mg/kg/dose)은 3–6개월마다 투여한다[17,18]. 이는 면역글로불린의 용량에 따른 생체 내 유지기간을 치료방법에 간접적으로 반영한 것이다. Sonobe et al.[19]과 Tacke et al.[12]은 IVIG 치료를 받은 KD 소아에서 홍역 항체 농도의 변화를 보고하였다. 대부분의 KD 환자에서 IVIG 치료 6개월 후에는 홍역 항체가 검출되지 않았다(Fig. 1). 이 결과를 토대로, 일본과 일부 유럽 국가에서는 우리나라나 미국과는 다르게 고용량 IVIG 치료 6개월 또는 9개월 후 홍역 또는 홍역포함 백신을 접종한다[20,21]. IVIG 치료와 예방접종 간격이 너무 짧으면 백신의 효능이 저하될 수 있고, 반면에 간격이 너무 길면 미접종 질환에 이환될 위험도가 높아진다[12]. 현재 우리나라는 미국의 지침을 토대로 IVIG 치료 11개월 후 홍역 백신을 권장하는데, IVIG의 생체 내 유지기간이 인종에 따라서 다를 수 있으므로, 적절한 예방접종 간격을 확인하기 위해서는 국내 혈청역학적 연구가 필요할 것이다.
첫째, IVIG 치료 후 생백신 접종은, 금기사항(contraindication) 즉 백신 접종으로 인해 심각한 부작용의 발생을 의미하는 것이 아니라, 주의사항(precaution) 즉 백신을 접종할 때 면역원성(immunogenicity) 저하가 예상되어 접종을 연기해야 하는 상황이라는 것을 이해해야 한다[10]. 예를 들어, 홍역이 유행할 때는 모체로 받은 항체가 아직 남아있는 생후 6–12개월 미만 영아들에게도 홍역 백신을 접종한다[22,23]. 이는 모체의 항체가 홍역에 대한 면역원성을 저하시킬 수 있지만 홍역에 대한 어느 정도의 예방효과를 기대할 수 있기 때문이다. 하지만 생후 12개월 이전의 백신 접종은 모체의 항체에 영향을 받았을 것이므로 접종 횟수에 포함시키지 않고 원래 예방접종 일정대로 홍역 백신을 생후 12–15개월과 4–6세에 2회 접종한다[24–26]. 마찬가지로 고용량 IVIG 치료 후 11개월이 경과하지 않았더라도, 홍역 환자와 접촉 등 임상적으로 필요한 상황에서는 홍역 백신을 접종한다[20].
실제로, IVIG 치료는 홍역과 풍진 백신의 면역반응을 일정기간 저하시킨다는 것이 객관적으로 증명되었다[22,23]. 수두 백신의 면역원성 저하에 대한 자료는 아직 부족하지만, 그 가능성을 고려하여 홍역 백신과 같은 원칙을 적용한다[26]. 일본뇌염 생백신의 경우도 근거 자료는 충분하지 못하지만, 홍역 백신에 준하여 접종을 연기한다[10]. 동일한 원칙에 따라, 고용량 IVIG 치료는 2 주 이내 접종했던 홍역 백신 또는 이에 준한 생백신의 면역원성을 저하시키므로, IVIG 치료 11개월 후 동일한 생백신을 재접종해야 한다[11,12].
둘째, 홍역이나 수두, 일본뇌염 생백신을 제외한 다른 생백신은 IVIG 치료와 무관하게 원래 일정대로 접종한다. 로타바이러스 경구 생백신, 황열(yellow fever) 백신, 과거 사용되었던 경구용 소아마비 백신(oral poliovirus vaccine, OPV), 독감 생백신은 IVIG 치료와 무관하게 접종하도록 추천된다[27,28].
셋째, IVIG 치료는 불활성화(inactivated) 백신, 소위 사백신 면역반응의 저해와는 무관하다[29]. 예를 들어, B형 간염 백신과 항체(hepatitis B immunoglobin, HBIG)를 동시 투여하는 것과 파상풍 디프테리아(tetanus diphtheria, Td) 백신과 파상풍 항체(tetanus immunoglobulin, TIG)를 동시 접종한다[21]. 즉, IVIG 치료와 무관하게 불활성화 백신은 원래 일정대로 접종을 시행한다.
KD 환자는 저용량(3–5 mg/kg/day) 아스피린을 8주 동안 복용하며, CAAs으로 1년 이상 아스피린을 복용해야 하는 경우도 적지 않다[2]. 이부프로펜(ibuprofen)은 아스피린의 항혈소판 기전을 길항하기 때문에, 아스피린을 복용하는 소아에게 추천되지 않는 해열제이다[13,14]. 또한 아스피린 복용 소아와 함께 거주하는 식구들은 계절 독감 백신을 접종하도록 한다. 라이증후군(Reye’s syndrome)은 드물지만 이론적인 발생 가능성을 고려하여, 아스피린을 복용 중인 소아가 독감 또는 수두에 노출되거나 감염되었을 때, 전문가와 상담하는 것이 필요하다[15,16].
일반적으로 피부 도포나 흡입 요법과 같은 국소 스테로이드 치료 그리고 저용량 또는 중등도 용량의 전신 스테로이드(prednisolone 2 mg/kg/day 미만 또는 체중 10 kg 소아에서 20 mg/day 미만) 치료 중인 소아는 불활성화 백신과 생백신 접종이 가능하다[30,31]. 스테로이드가 KD 환자에 사용될 경우 대부분 급성기에 단기간 동안 적용되므로, 주요한 고려사항은 아닐 것이다. 하지만 고용량 스테로이드(prednisolone 2 mg/kg/day 이상)를 14일 이상 치료받은 환자는 생백신 접종을 1개월 후로 연기한다[32]. 그 밖의 면역억제제를 치료받은 KD 환자는 치료 중단 3개월 후에 생백신을 접종하도록 권장한다[33].
결론
IVIG 치료 후 일정기간 동안 생체 내 농도가 유지되어 예방접종에 영향을 준다. 항체의 종류, 용량, 투여 방법 등 면역글로불린의 특성과 연령, 성별, 인종 등 숙주의 특성이 IVIG의 생체 내 유지기간을 결정한다. 우리나라와 미국에서는 고용량 IVIG 치료와 홍역이나 수두 포함 생백신의 접종간격을 11개월 후로 권장한다. 하지만, 일본이나 유럽 일부 국가에서는 그보다 짧은 접종간격을 권장한다. IVIG 치료 후 너무 빨리 예방접종을 시행하면 백신의 면역원성을 저하시킬 수 있고 너무 늦게 예방접종을 시행하면 미접종 질환에 이환될 위험도가 높아진다. IVIG 치료 후 적절한 예방접종 간격을 결정하기 위해 국내 소아환자를 대상하는 연구가 필요한 시점이다.







