서론
소아다기관염증후군(multisystem inflammatory syndrome in children, MIS-C)은 코로나바이러스감염증-19(coronavirus disease 2019, COVID-19)의 드물지만 심각한 합병증이다[1]. MIS-C의 특징은 신종 코로나바이러스(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) 감염에 의해 촉발된 전신염증과 장기부전이며, 이 세가지 요소를 증명하여 MIS-C를 진단한다(Table 1). 많은 MIS-C 환자들이 가와사키병(Kawasaki disease, KD) 진단기준에 포함되는 ‘KD-유사증상’(KD-like features)을 보여 임상적 관심을 받았다[1,2]. 실제로 MIS-C와 KD는 임상 및 검사실 소견에서 많은 유사점을 공유한다[3,4]. 하지만 인구통계학적으로 KD와는 다르게, MIS-C는 상대적으로 흑인과 히스패닉 인종에 흔하고 아시아 인종에는 드물다[5]. 국내에는 MIS-C 발생 자체가 적어서인지, MIS-C에 관한 대부분의 연구는 복수의 환자를 대상으로 하는 임상연구보다는 종설이나 증례보고 형태이다.
CSTE/CDC: The Council of State and Territorial Epidemiologists/Centers for Disease Control and Disease Prevention; MIS-C: multisystem inflammatory syndrome in children; CRP: C-reactive protein; EF: ejection fraction; CAAs: coronary artery abnormalities; Tn: troponin; ALC: absolute lymphocyte count; SARS-CoV-2: severe acute respiratory syndrome coronavirus 2.
MIS-C 환자의 조직손상과 장기부전은 선천면역(innate immunity)에 의해 매개된다고 알려져 있다[3,6]. 조절에서 벗어난 면역반응은 대식세포활성증후군(macrophage activation syndrome, MAS)의 치명적인 염증반응과 유사한 사이토카인 폭풍(cytokine storm)을 일으킨다[7,8]. 고페리틴혈증(hyperferritinemia)은 사이토카인 폭풍과 같은 심한 염증반응이 발생할 때 동반되는 검사실 소견이다[9]. 페리틴(ferritin) 수치는 염증의 중증도에 비례하여 증가하는데, 이러한 특성은 감염, 류마티스 및 혈액종양 등의 여러 종류 질환의 진단과 질병 활성도 평가에 적용되고 있다[6,10]. ‘중증(severe) COVID-19’ 성인 환자 대상의 연구에서, 생존(survivor) 환자군에 비해 비생존(non-survivor) 환자군에서 페리틴 수치의 급격한 증가가 확인되었다[11]. 이는 MIS-C 환자에서도 페리틴 검사가 단순히 전신염증을 입증하는 것뿐만 아니라, 임상적으로 좀더 다양한 측면에서 활용될 수 있음을 의미한다.
본 연구에서는 국내 MIS-C 환자의 임상양상을 조사하고, 고페리틴혈증 동반 MIS-C 환자와 고페리틴혈증이 없는 MIS-C 환자의 특징을 비교하여, MIS-C 환자에서 페리틴 검사의 의의를 확인하려고 한다.
대상과 방법
2020년 1월부터 2022년 12월까지(COVID-19 팬데믹 3년) 가톨릭의대 4개 병원(서울성모병원, 은평성모병원, 부천성모병원, 대전성모병원) 소아청소년과에 MIS-C로 입원한 환자의 의무기록을 후향적으로 조사한 연구[12]이다. MIS-C 진단코드(U10.9)의 환자 중 2023년의 새로운 사례정의(Table 1)를 만족하면서 입원기간 동안 MIS-C에 대한 검사(페리틴 포함)를 시행받고 치료를 위해 정맥주사 면역글로불린(intravenous immunoglobulin, IVIG) 혹은 정맥주사 스테로이드(intravenous methylprednisolone, IVMP) 등, 한가지 이상의 면역조절제를 투여받은 환자를 대상으로 선정하였다. MIS-C 사례정의를 만족하지 못하거나, MIS-C에 대한 검사와 치료 미시행 혹은 이에 대한 기록 누락 환자, MIS-C로 2회 이상 입원한 환자 그리고 치료 도중에 다른 병원으로 전원된 환자는 제외시켰다. 대상환자는 페리틴 수치를 토대로, ‘고페리틴혈증(페리틴 > 500 ng/mL) 동반 MIS-C군’과 ‘고페리틴혈증 없는 MIS-C군’으로 양분하였다.
MIS-C 진단에는 미국의 국가 및 영토 역학위원회 및 질병통제예방센터(Council of State and Territorial Epidemiologists/Centers for Disease Control and Disease Prevention, CSTE/CDC)에서 새롭게 제정한 2023년 MIS-C 사례정의[13]를 이용했다. KD는 미국심장학회(American Heart Association, AHA) 기준[14]에 따라 완전형(complete)과 불완전형(incomplete)으로 진단하였다. 일차치료의 실패(즉, IVIG 저항성)는 첫번째 IVIG ± IVMP 치료 종결 36시간 후에 발열이 지속되어 두번째 면역조절제가 투여된 경우로 정의하였다[15]. 관상동맥 이상(coronary artery abnormalities, CAAs)은 AHA의 Z score 기준에 따라, Z score 2.0 이상은 관상동맥 확장으로, Z score 2.5 이상은 관상동맥류로 정의하였다[14].
임상적 항목으로 연령, 성별, 입원기간, 입원시 활력증후, 발열 기간, KD-유사증상(발진, 결막염, 입술과 입 안의 염증, 손발의 변화, 경부림프절 비대) 및 장기부전의 양상(심장, 점막피부, 쇼크, 소화기, 혈액학적, 그 밖의 주요 장기)이 포함되었다. 검사실 항목으로 혈색소, 백혈구, 절대 림프구(absolute lymphocyte count, ALC), 혈소판, 적혈구 침강속도(erythrocyte sedimentation rate, ESR), C-반응단백(C-reactive protein, CRP), aspartate aminotransferase (AST), alanine aminotransferase(ALT), 알부민, N-terminal pro-brain natriuretic peptide(NT-proBNP), 트로포닌(troponin), 페리틴, 중성지방, 섬유소원(fibrinogen), 응고이상(international normalized ratio, INR) 및 농뇨(pyuria)를 조사하였고, 별도로 2016년 MAS 진단기준[16]의 충족 여부를 평가하였다. 미생물학적 검사(일반 바이러스와 세균 배양검사, polymerase chain reaction (PCR) 및 혈청학)와 심장 초음파 검사 결과도 확인하였다.
SARS-CoV-2 감염 증명을 위해, 과거 COVID-19 이환력과 당시 시행한 검사 결과 그리고 입원시 SARS-CoV-2에 대한 PCR, 항원 및 항체 검사 결과를 확인하였다. 치료와 임상경과의 평가를 위해, 일차 치료약제, 치료 실패에 대한 추가적 치료약제, 경험적 항생제, 혈압상승제, 중환자실 입실 및 사망 여부를 조사하였다. 또한 KD 환자와 비교한 MIS-C 환자 발생현황을 파악하기 위해, 연구기간 3년 동안 KD로 입원한 환자 수도 조사하였다.
결과
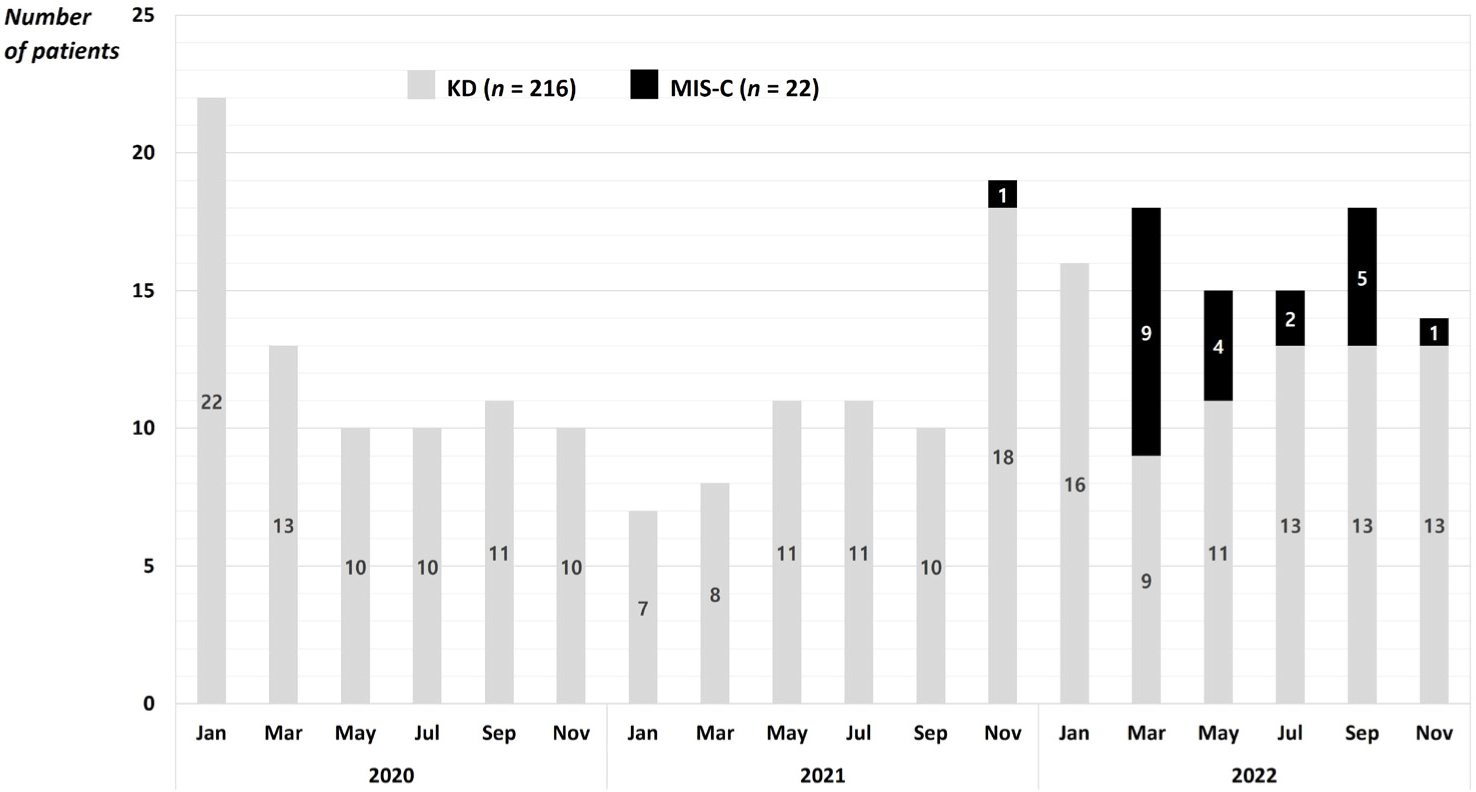
사례정의를 만족하지 못한 환자 4명과 전원된 환자 1명을 제외하고, 총 22명의 MIS-C 환자가 연구대상으로 선정되었다. 이중 11명(50.0%)은 고페리틴혈증 동반 MIS-C군으로, 나머지 11명(50.0%)은 고페리틴혈증 없는 MIS-C군으로 할당되었다. 모든 환자들(100.0%)은 (1) 전신염증(CRP ≥ 3.0 mg/dL)과 (2) 두 가지 이상 장기의 기능부전을 나타냈고, (3) 미생물학적으로 SARS-CoV-2 감염이 증명되었다. 연도별 MIS-C 입원 환자수는 2020년 0명(0.0%), 2021년 1명(4.6%), 2022년 21명(95.4%)이며, Fig. 1에 KD 환자와 비교한 MIS-C 환자 발생현황을 나타냈다. MIS-C/KD 비율은 0.10(22/216)으로, 미국 MIS-C/KD 비율 1.66(31.6/19.0)의 1/16 수준이다[17].
전체 환자 연령의 중앙값은 9.3세(0.9–16.0)였고, 남녀 성비는 1:1이었다. 입원기간의 중앙값은 10.0일(4.0–18.0), 입원 전 발열기간의 중앙값은 5.0일(3.0–15.0)이었다. KD-유사증상 중에는 발진(77.3%)과 결막염(81.8%)이 흔하였고, 입술과 입 안의 염증, 손발의 변화, 경부림프절 비대는 각각 45.5%, 59.1%, 68.2%의 환자에서 관찰되었다. KD 진단기준을 만족한 환자는 19명(86.4%)이며, 이중 11명(50.0%)은 완전형 KD였다. 장기부전 측면에서, 심장 증상 12명(54.5%), 점막피부 증상 21명(95.5%), 쇼크 증상 6명(27.3%), 소화기 증상 20명(90.9%), 혈액학적 증상 17명(77.3%), 그 외 호흡기, 신경 혹은 신장 증상은 14명(63.6%)에서 관찰되었다.
Table 2에는 고페리틴혈증 동반 MIS-C군과 고페리틴혈증이 없는 MIS-C군의 임상적 특징과 장기침범 양상을 비교하였다. 연령, 성비, KD-유사증상을 포함한 임상적 특징에는 두 군간 유의한 차이가 없었고, 장기침범 양상에는 쇼크 증상의 빈도(54.5%)와 침범된 장기의 중앙값(4.0)이 고페리틴혈증 없는 MIS-C군보다 고페리틴혈증 동반 MIS-C군에서 높았다(P < 0.05).
| MIS-C with hyperferritinemia (n = 11) | MIS-C without hyperferritinemia (n = 11) | P value | |
|---|---|---|---|
| Clinical | |||
| Age, year | 9.1 (4.1–16.0) | 9.5 (0.9–12.0) | 0.669 |
| Male sex | 5 (45.5) | 6 (54.5) | 0.670 |
| Length of hospital stays, day | 10.0 (5.0–18.0) | 6.0 (4.0–15.0) | 0.072 |
| Fever duration, day | 5.0 (3.0–15.0) | 5.0 (3.0–10.0) | 0.917 |
| Skin rash | 7 (63.6) | 10 (90.9) | 0.311 |
| Met KD criteria | 10 (90.9) | 9 (81.8) | 1.000 |
| Complete KD | 6 (54.5) | 5 (45.5) | 1.000 |
| Organ involvement (see Table 1) | |||
| Cardiac involvement | 8 (72.7) | 4 (36.4) | 0.198 |
| Mucocutaneous involvement | 11 (100.0) | 10 (90.9) | 1.000 |
| Shock | 6 (54.5) | 0 (0.0) | 0.012 |
| Gastrointestinal involvement | 11 (100.0) | 9 (81.8) | 0.476 |
| Hematologic involvement | 10 (90.9) | 7 (63.6) | 0.311 |
| Others: respiratory, neurologic, or renal1) | 8 (72.7) | 6 (54.5) | 0.659 |
| Number of organs involved | 4.0 (2.0–5.0) | 3.0 (2.0–4.0) | 0.002 |
Data are presented as frequency (%) or median (range). MIS-C: multisystem inflammatory syndrome in children; KD: Kawasaki disease.
The Council of State and Territorial Epidemiologists/Centers for Disease Control and Disease Prevention (CSTE/CDC) case definition includes five types of organ involvement (i.e., cardiac, mucocutaneous, shock, gastrointestinal, and hematologic). Other organ dysfunction (e.g., respiratory, neurologic, renal, or musculoskeletal) is not included in the CSTE/CSC case definition.
전체 환자의 검사실 소견은 다음과 같다: 혈색소 12.1 g/dL (9.6–14.9), 백혈구 7,200 /μL (2,350–20,390), ALC 937 /μL (198–6,890), 혈소판 130 × 103 /μL (62–431), ESR 26 mm/hr (2–120), CRP 10.1 mg/dL (3.2–25.5; 정상 < 5.0 mg/L), AST 55 U/L (33–579), ALT 54 U/L (13–232), 알부민 2.9 g/dL (2.4–4.1), NT-proBNP 1,464 pg/dL (299–10,364), 페리틴 566 ng/mL (158–10,364), 트로포닌 상승 8명(36.4%), 중성지방 혹은 섬유소원 이상 17명(77.3%), 응고이상 15명(68.2%) 및 2016년 MAS 진단기준 만족 11명(50%)이었다.
Table 3에는 고페리틴혈증 동반 MIS-C군과 고페리틴혈증 없는 MIS-C군의 검사실 특징을 비교하였다. 고페리틴혈증 없는 MIS-C군과 비교하여, 고페리틴혈증 동반 MIS-C군에서 혈소판 수치와 알부민 수치는 낮았고 페리틴 수치는 높았으며, 트로포닌 상승 환자의 비율과 2016년 MAS 진단기준 만족 환자의 비율이 높았다(P < 0.05).
Data are presented as frequency (%) or median (range). MIS-C: multisystem inflammatory syndrome in children; WBC: white blood cell; ALC: absolute lymphocyte count; ESR: erythrocyte sedimentation rate; CRP: C-reactive protein; AST: aspartate transaminase; ALT: alanine transaminase; NT-proBNP: N-terminal pro-brain natriuretic peptide; Tn: troponin; TG: triglyceride; INR: international normalized ratio; hpf: high-power field; MAS: macrophage activation syndrome.
MAS is diagnosed when ferritin > 684 ng/mL and 2 of 4 criteria (platelets ≤ 181,000/μL, AST > 48 U/L, TG > 156 mg/dL, or fibrinogen ≤ 360 mg/dL) [16].
MIS-C에 대한 초기 치료에 IVIG 투여 받은 환자는 19명(86.4%)이었다. 일차치료 실패(IVIG 저항성) 환자는 7명(31.8%)이었고, 추가적 IVIG는 4명(18.2%), 추가적 IVMP는 7명(31.8%), 생물학적 제제(anakinra)는 1명(4.5%)에서 시행되었다. 두 가지 이상의 면역조절제 치료받은 환자는 17명(77.3%)이었다. 경험적 항생제는 19명(86.4%), 혈압상승제는 5명(22.7%) 및 중환자실 입실은 5명(22.7%)에서 시행되었다. CAAs은 5명(22.7%)에서 확인되었으며, 사망한 환자(0.0%)는 없었다.
Table 4에는 고페리틴혈증 동반 MIS-C군과 고페리틴혈증 없는 MIS-C군의 치료와 임상경과를 비교하였다. 고페리틴혈증이 없는 MIS-C군과 비교하여, 고페리틴혈증 동반 MIS-C군에서는 두 가지 이상의 면역조절제 치료받은 환자의 비율, 혈압상승제 투여 환자의 비율 및 중환자실 입실 환자의 비율이 높았다(P < 0.05).
고찰
본 연구에서 COVID-19 팬데믹 기간 동안 국내 병원에 입원한 MIS-C 환자 22명의 특징을 조사하였다. 전체 MIS-C 환자 중 11명(50%)에서 고페리틴혈증이 관찰되었다. 고페리틴혈증 동반 MIS-C군(n = 11)과 고페리틴혈증 없는 MIS-C군(n = 11)의 비교할 때, 인구학적 특징과 임상적 소견에는 유의한 차이가 없었고, 장기침범 양상과 검사실 소견에는 고페리틴혈증 동반 MIS-C군에서 좀더 심한 양상을 보였다. 치료적 측면에서도 고페리틴혈증 동반 MIS-C군에서 두 가지 이상의 면역조절제와 혈압상승제 치료 그리고 중환자실 입실이 필요했던 환자의 비율이 높았다.
소아 COVID-19는 성인에 비해 임상경과가 심하지 않다고 알려져 있다[1,2]. 하지만, 2020년 4월 이탈리아에서 Verdoni et al.[3]은 SARS-CoV-2 감염 후 심한 전신염증, 쇼크 증상을 포함한 장기침범 그리고 KD 유사증상을 보이는 소아 및 청소년을 보고하였다. 이 심각한 COVID-19 합병증은 영국, 스페인, 프랑스, 미국, 인도, 브라질 등에서도 보고되었고 ‘COVID-19 연관 소아다기관염증증후군(MIS-C)’이라 명명되었다[4]. Verdoni et al.[3]의 MIS-C 환자(n = 10)는 모두 KD 진단기준을 만족하였고 50%는 고페리틴혈증(> 500 ng/mL)을 보였으며 80%는 두 가지 이상의 면역조절제, 20%는 혈압상승제 치료를 받았고 다행히 모두 회복되었다. 이는 전반적으로 본 연구와 유사한 결과이다. Feldstein et al.[18]의 연구(n = 186)에서 KD 진단기준 만족 비율 40%, 고페리틴혈증 61%, 추가적 면역조절제 69%, 혈압상승제 48% 및 사망률 2%(4/186)를 보고하였는데, 이는 본 연구에 비해 KD 진단기준 만족 비율은 낮고 검사실 소견, 치료양식 및 임상경과는 좀 더 심한 양상이다.
MIS-C는 임상적 특징과 중증도에 따라 분류할 수 있다. Table 5에는 MIS-C 사례 보고가 급증했던 2020년 8월 미국 질병통제예방센터(CDC)가 제안한 분류법(class 1, 2 및 3)을 요약하였다[19,20]. Class 1은 급성 COVID-19의 호흡기 증상과 KD-유사증상의 빈도는 낮고 심한 검사실 소견과 더 많은 장기의 침범을 특징으로 하는 ‘전형적(classic) MIS-C’로 전체 환자의 약 35%(n = 203)를 차지한다. Class 2는 성인의 중증 COVID-19와 유사한 양상으로, 대부분 호흡기 증상을 보이며 SARS-CoV-2 PCR에 대한 높은 양성률을 보이는 ‘급성(acute) COVID-19 MIS-C’로 전체 환자의 약 30%(n = 169)를 차지한다. Class 3는 class 1과 2에 비해 KD-유사증상은 흔하지만 전신염증과 장기침범의 정도는 심하지 않은 ‘KD-유사(KD-like) MIS-C’로, 전체 환자의 약 35%(n = 198)를 차지한다. 본 연구의 MIS-C 환자들은 연령 중앙값, 장기침범의 정도, 치료 및 경과는 class 1와 유사하였고 KD-유사증상의 빈도는 class 3과 유사하였다(Table 5). 국외 연구[18-20]와 가장 큰 차이점은 고페리틴혈증이 동반된 심한 MIS-C 환자에서 KD-유사증상의 빈도가 높았다는 것이다. 이러한 차이는 소규모 연구라서 나타난 현상일 수 있겠으나, KD의 발생률은 높고 MIS-C의 발생률은 낮은 아시아 인종의 특징일 수도 있다[21].
PCR (–) & Ab (+) indicate that there is no more virus but a serious post-infectious inflammatory response, which is the key pathogenesis of MIS-C.
MIS-C: multisystem inflammatory syndrome in children; CDC: Centers for Disease Control and Disease Prevention; COVID-19: coronavirus disease 2019; KD: Kawasaki disease; PCR: polymerase chain reaction; Ab: antibodies; IVIG: intravenous immunoglobulin; ICU: intensive care unit; ARDS: acute respiratory distress syndrome.
KD-유사증상은 장기침범의 한 형태로 MIS-C 사례 정의에 포함되는 MIS-C의 흥미로운 특징이다[13]. 하지만 KD-유사증상은 질병 초기에 나타나지 않기도 하고 일부(~25%) 환자에서는 질병의 전 과정 동안 전혀 나타내지 않을 수 있어, MIS-C 진단 지연의 원인이 되기도 한다[18,22]. 국내 첫 MIS-C 소아 환자[23]의 경우, 초기에 KD-유사증상 없이 발열과 복통, 쇼크 증상을 보여 위장관계 감염에 의한 패혈증 쇼크로 오인되기도 하였다. 발진, 결막염 및 입술과 입 안의 염증은 입원 6일째 나타났고 혈청학에서 SARS-CoV-2 감염이 입증되어 최종적으로 MIS-C로 진단되었다. 따라서 KD-유사증상 유무와 무관하게, 원인이 설명되지 않는 심부전, 복통 및 쇼크 증상을 보이는 환자에서 MIS-C의 동반 가능성을 고려해야 하는 것이 중요하다[5]. 페리틴 수치는 모호한 의학적 상황에서 MIS-C 감별진단을 위해 필수적으로 확인해야 하는 검사항목이다[4].
페리틴은 철(iron) 저장 단백질로 우리 몸에서 철분 대사작용뿐만 아니라 중요한 면역학적 기능을 수행한다. 고페리틴혈증에 관한 Senjo et al.[9]의 연구(n = 1,394)에서, 페리틴 수치 500 ng/mL 이상인 질환은 감염 질환(44.8%), 고형장기 종양(26.3%), 간기능 이상(20.3%), 신장 부전(20.2%), 혈액 악성종양(12.0%), 철분대사 이상(6.9%), 류마티스/염증 질환(6.3%), MAS (1.4%) 등의 순으로 보고했다. 페리틴 중앙값이 높은 질환은 MAS (44,901 ng/mL), 혈액 및 고형장기 종양(1,165–1,330 ng/mL) 그리고 류마티스/염증 질환(1,142 ng/mL) 등의 순이었다. 페리틴 자체는 비특이적 급성기 반응 물질(acute phase reactant)이지만, 숙주 염증의 중증도에 따라 구별되는 특성을 보이기에, 류마티스 질환이나 혈액종양 질환뿐만 아니라 심한 전신염증을 유발하는 다양한 임상적 상황에서 페리틴을 활용할 수 있다[6,8].
최근 KD 연구에서 페리틴 평가의 유용성이 제시되었다[24–28]. KD 환자에서 페리틴 검사를 통해, KD와 일반 열성질환(nonspecific febrile illnesses)을 구분하고[24] KD 환자의 IVIG 저항성과 CAAs 발생 가능성을 예측하며[25], 드물지만(1%–2%) 심각한 경과의 KD 합병 MAS (KD complicated with MAS)을 조기에 진단할 수 있다[26,28]. 이러한 임상적 유용성을 토대로, 페리틴 검사가 치료불응 KD와 같은 심한 형태의 KD 환자에서는 필수 검사항목에 포함되어야 한다고 제안되었다[10,15]. 유사한 이유에서, 페리틴 검사는 일반 COVID-19 소아 환자에서 필수가 아니겠지만 MIS-C 환자와 중증 COVID-19 환자에서는 필수적으로 시행되어야 한다고 여겨진다. 이미 많은 의료기관에서 MIS-C 환자에서 페리틴 검사를 시행하지만 진단시 심한 전신염증 확인을 위한 검사뿐만 아니라, 연속적으로 페리틴 수치를 확인하여 치료반응을 평가하고 예후를 예측할 수 있다. 다양한 소아 질환에서 시행된 페리틴에 대한 연구를 종합하여 각 질환들을 페리틴의 평균값 혹은 중앙값 순서로 나열하면, 일반 열성질환(예, 아데노바이러스 감염; 107 ng/mL 미만)[24] < 전형적 KD (121 ng/mL 이상)[24] < 치료불응 KD (165 ng/mL 이상)[25] < MIS-C (566 ng/mL)[12] < KD 쇼크증후군 (756 ng/mL)[12] < KD 합병 MAS (3,490 ng/mL)[27] 순이다. 즉, KD-유사증상(발진, 결막염, 입술과 입 안의 염증 등)을 나타낼 수 있는 다양한 과염증 질환들(KD-like hyperinflammatory diseases)을 MIS-C와 구분할 때 페리틴 검사가 활용 가능하다[5].
본 연구는 대상환자가 소규모이며 제한된 지역 병원에 입원한 MIS-C 환자의 의무기록을 후향적으로 조사하였기에 그 결과를 특정 지역이나 국가 전체의 자료로 대체하기에는 한계가 있다. 또한, 진단코드를 이용하여 대상환자를 선별하였기에 실제 환자가 누락되었을 수 있고 그에 따라 MIS-C 발생빈도와 임상양상이 과소 평가되었을 수 있다. 하지만 본 연구에서 아직 많은 자료가 필요한 국내 MIS-C의 대략적 발생현황과 임상양상을 조사하였고 고페리틴혈증이 전신염증과 장기침범 측면에서 심한 MIS-C의 특징이라는 것을 확인하였다. COVID-19 팬데믹 종결이 선언된 시점에서 MIS-C의 역학적, 임상적 변화를 확인하기 위한 추가적 연구가 요구된다.
