서론
가와사키병은 산업화된 국가의 소아청소년에서 가장 빈도가 높은 후천성 심장 질환이다[1]. 그 발병 원인은 아직 알려져 있지 않다. 질환의 주후유증이 관상동맥 병변임은 잘 알려져 있다. 급성기에 면역 글로불린을 투여하는 것이 전세계적으로 인정된 치료 방법으로서, 관상동맥 합병증 발생을 효과적으로 예방할 수 있다[2,3]. 그러나, 면역 글로불린의 사용이 일반화된 근래에 있어서도 관상동맥류의 빈도는 2% 내외로 보고되고 있다[4,5].
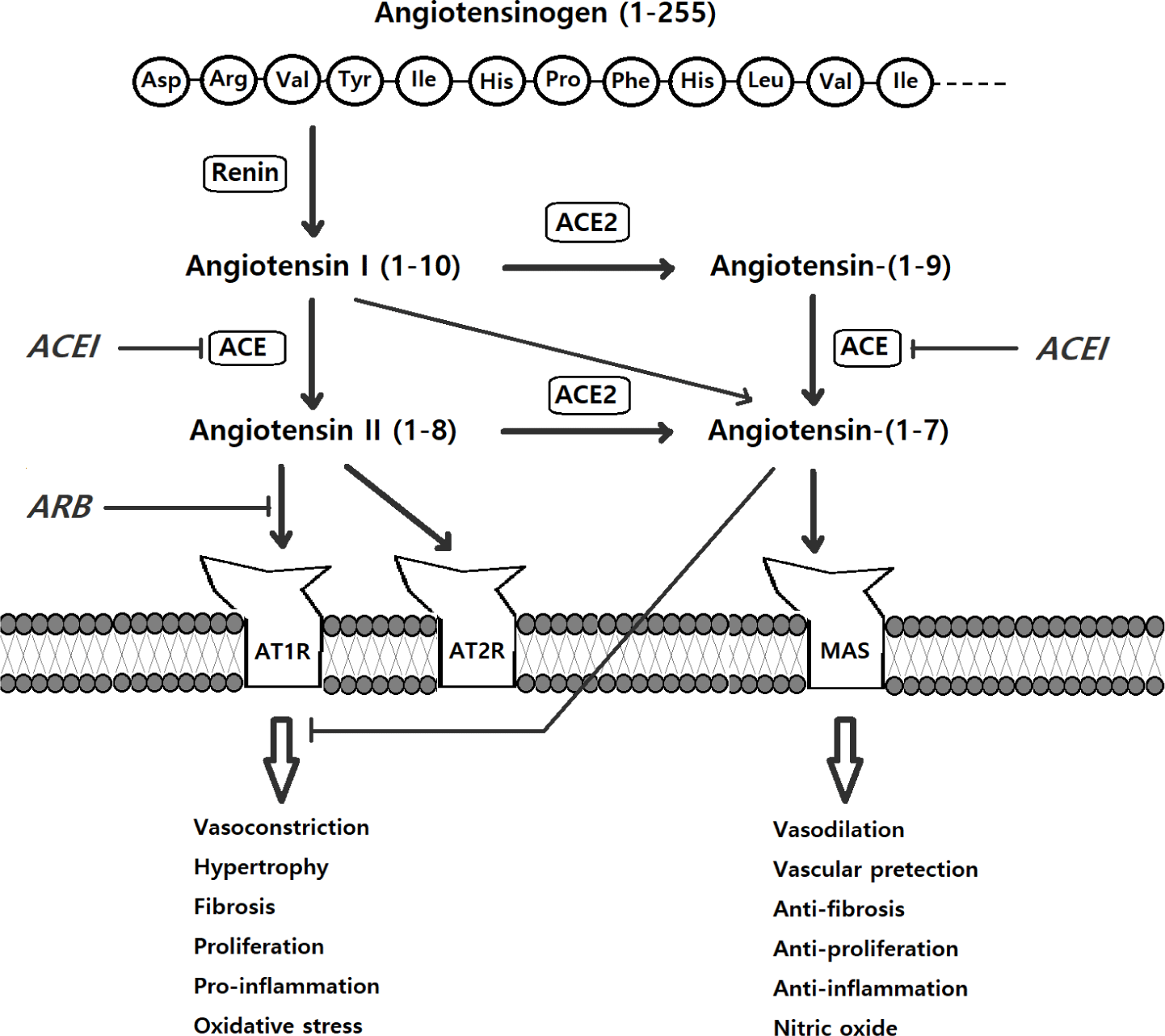
레닌-안지오텐신 시스템(Fig. 1)은 혈압 조절과 심장혈관계의 항상성 유지에 있어서 매우 중요한 인자이다[6]. 안지오텐신II가 안지오텐신II 수용체에 결합한 결과, 혈관 평활근 세포의 비대, 세포 외 결체조직의 증식, 산화물의 축적, 세포결합분자/증식인자/싸이토카인/케모카인 들의 분비가 촉진될 수 있다[7]. 가와사키병의 장기 관찰 시의 혈관 내피 증식에 따른 관상동맥류의 협착이 이러한 레닌-안지오텐신 시스템의 활성화의 결과일 것으로 추측되고 있기도 하다[8]. 장기 관찰 시의 협착 이외에도 가와사키병의 발병 자체 혹은 관상동맥류의 발생에서의 레닌-안지오텐신 시스템의 연관성이 지속적으로 소수의 연구자들에 의해 발표되어져 왔다. 본 논문은 이러한 근래의 연구 발표들을 취합 정리하여, 안지오텐신 전환 효소 억제제 혹은 안지오텐신 수용체 차단제를 임상에서 활용하는 것의 근거를 알아보고자 하였다.
본론
레닌-안지오텐신 시스템에서의 유전자 다형성이 성인의 심혈관 질환에서 위험인자로 연구되어진 성과를 참고하여[9-11], 가와사키병 환자들을 대상으로 레닌-안지오텐신 시스템에서의 유전자 다형성이 발병 자체 혹은 관상동맥 합병증의 발병에 의미 있는 위험인자인지에 대한 연구들이 있어 왔다[12-16]. 안지오텐신 전환 효소의 유전자는 염색체 17q23 위치에 있으며 다양한 유전자 다형성이 보고되어 왔다. 인트론 16의 insertion/deletion(I/D, rs4646994) 다형성은 287 염기쌍의 Alu repetitive sequence의 존재 혹은 부재로 정의되는데, 이 다형성에 대한 연구들이 근래에 있어 왔다[12-14]. 그러나 연구들의 결과가 일관되지 않아서, Pan과 Lu가 기존의 연구들에 대한 메타 분석을 시도하였고, 다형성과 가와사키병 발병 간에 의미 있는 연관이 있는 것으로 발표한 일이 있다[15]. DI heterozygote에서 II homozygote에 비해 의미 있게 가와사키병의 발병율이 높았다는 것이 주요한 내용으로 보여지는데, D allele이 I allele에 비해 더 발병율이 높은 지와 DD homozygote 형태가 더 높은 발병율을 보이는 것의 증명에는 실패한 한계가 있다. 혈장 안지오텐신 전환 효소의 농도는 DD homozygote에서 가장 높고, II homozygote에서 가장 낮은 것이 알려져 있다[9]. 한편, Takeuchi 등은 가와사키병 환자들 만으로 구성된 연구에서 II homozygote 형태가 관상동맥 합병증과 더 의미 있게 연관되었다는 보고를 한 일도 있다[17]. 안지오텐신 전환효소 I/D 다형성과 가와사키병의 연관에 대해서는, 향후 일관된 결과가 추가로 산출되어야 할 것으로 보인다.
Liu 등은 안지오텐시노겐 유전자의 두 가지 다형성(rs699A > G와 rs5050T > G)에 대한 연구에서 이들이 가와사키병의 발병에는 관련이 없으나, rs5050T > G의 경우 관상동맥류의 발생에 유의한 연관을 보였다고 보고하였다[16]. 향후 이에 대한 추가적 연구들이 필요할 것으로 보인다.
안지오텐신 전환 효소2는 관상동맥을 포함한 혈관 전반의 내피세포, 심근, 심장섬유세포 들에서 발현되며[18], 혈관 내피세포의 기능을 보존하고 죽상동맥경화 병변을 예방하며 nitric oxide/산화 물질의 분비를 조절하여 혈관 기능을 유지하는 역할을 하는 것으로 알려져 있다[19,20]. Gan 등은 49명의 환자들을 포함한 연구에서 안지오텐신 전환 효소2가 정상 대조군에 비해 유의하게 증가되어 있는 것을 발표하였다[21]. 안지오텐신 전환 효소의 경우 가와사키병 발병 시 치료 전에 감소되어 있다가 면역글로불린 투여 후 회복되는 추세를 보이므로[22], 이와는 대조되는 결과이다. Gan 등은 그들의 결과에 대해 안지오텐신 전환 효소2의 상승이 가와사키병에서의 혈관 손상/염증의 주요 기전일 가능성을 제시하였다[21]. 그러나, 효소 상승의 진단적 가치와 향후 예후 예측인자로서의 가치를 좀 더 확인하려면 추가적인 연구가 필요할 것으로 판단된다.
한편, coronavirus 2019(COVID-19)의 발병 원인인 severe acute respiratory syndrome-coronavirus(SARS-CoV) 혈관 침투 통로가 안지오텐신 전환 효소2인 것으로 알려져 있는데[23], COVID-19의 심각한 후유증인 소아 다기관 염증 증후군의 임상 양상이 가와사키병에서와 유사한 부분들이 있다는 점에서 흥미 있는 사실이다[24].
Inoue 등은 그들의 in vitro 실험 발표에서 안지오텐신 전환 효소 억제제를 가와사키병의 치료에 적용할 수 있을 가능성을 제시한 바 있다[25]. 그들은 captopril로 matrix metalloproteinase-9의 활성이 감소되는 것을 관찰하였는데[25], matrix metalloproteinase-9가 가와사키병 환자들의 관상동맥류의 형성에 영향을 미친다는 기존의 발표들에[26,27] 근거한 것이다. 안지오텐신 전환 효소 억제제가 matrix metalloproteinase-9를 억제하는 기전은 효소 활성 부위의 아연 chelation 에 의한 것이므로[25], 결과적으로 가와사키병에 유용한 효과를 기대함에 있어서 레닌-안지오텐신 시스템의 비활성화를 기대하는 것은 아닌 것으로 보인다.
Suganuma 등은 가와사키병 동물 모델 실험에서 losartan을 면역글로불린과 병용투여 함으로써 macrophage 침윤을 포함한 관상동맥 주변의 염증을 완화시키고, interleukin-1β, interleukin 10, monocyte chemotactic protein-1(MCP-1) 등을 포함한 여러 사이토카인들의 농도를 낮출 수 있다는 것을 발표하였다[28]. 이는 losartan에 의한 안지오텐신 II의 활성 억제가 주요한 기전일 것으로 추론되었는데, 면역글로불린과 losartan이 서로 다른 기전에 의해 항염 효과를 보이므로 병합 투여 시 상승 작용의 효과를 낼 수도 있을 가능성을 제시하기도 하였다[28].
안지오텐신 전환 효소 억제제 및 수용체 차단제를 관상동맥류가 합병된 환자들에서 급성기 이후에 투여하는 것은 JCS/JSCS 2020 가이드라인에 제시되어 있다[8]. 이는 관상동맥류의 협착을 예방하기 위한 것인데, 이미 협착이 발생한 경우에도 베타차단제나 칼슘 채널 차단제와 마찬가지로 심근 허혈을 예방하기 위하여 사용될 수 있다는 것이다[8]. 추천의 종류는 class IIb로서 아직은 그 효용성에 대해 정립되어 있지 않고, 근거의 강도는 level C로서 전문가들의 추천 수준의 근거이다[8]. 관상동맥류 발생 수일 이내에 candesartan 0.2−0.3 mg/kg/day 투여함으로써, 혈관 내피 증식을 억제함을 통해 관상동맥 협착을 방지하였다는 한 가지 연구를 인용하고 있긴 하나 해당 연구의 문헌을 찾아볼 수는 없었다. 한편 American Heart Association가이드라인에서는 관상동맥 병변의 상태에 따른 약제 추천에서 안지오텐신 전환 효소 억제제 및 수용체 차단제가 금기로 명시되어 있지는 않으나, 일차적으로 추천되어 있지도 않다[1]. 임신 여성에서 사용되고 있을 경우, 1st trimester 동안 기형 유발 위험 때문에 금기된다는 주의 사항이 제시되어 있다[1].
